Modelo atómico a lo largo de la historia

Tabla de Contenidos
La historia del átomo: teorías y modelos
Toda la materia está compuesta de átomos. Esto es lo que ahora damos por sentado, y una de las primeras cosas que aprenderá de inmediato al comienzo de su educación en química. A pesar de esto, nuestras ideas sobre lo que apareció un átomo recientemente: hace solo cien años, y los científicos todavía discuten sobre cómo se ve exactamente un átomo.
Se propuso una representación gráfica del modelo del átomo en el siglo XIX, pero la idea de un «átomo» existía mucho antes. La palabra «átomo» proviene del griego antiguo «ἄτομος» y se traduce aproximadamente como «indivisible». La teoría griega antigua se atribuye con mayor frecuencia a Demócrito (460-370 a. C.) y su mentor Leucipo. Aunque sus ideas sobre los átomos eran rudimentarias en comparación con el concepto actual de hoy, esbozaron la importante idea de que todo consiste en átomos: las esferas invisibles e indivisibles de la materia de tipo y número infinitos.
Demócrito de abdera
Los antiguos filósofos griegos sugirieron que los átomos difieren en su forma según el tipo. Por ejemplo, los átomos de hierro parecían ganchos que se aferraban entre sí, lo que explicaba por qué el hierro era sólido a temperatura ambiente, y los átomos de agua eran suaves y resbaladizos, por lo que el agua era líquida a temperatura ambiente. Y aunque ahora sabemos que esto no es así, sus ideas se establecieron en la base de futuros modelos atómicos.
Modelo de esfera sólida de John Dalton
Una nueva idea del átomo apareció solo en 1803, cuando el químico inglés John Dalton comenzó a desarrollar la definición científica del átomo. Se basó en las ideas de los antiguos griegos al describir los átomos como esferas pequeñas, sólidas e indivisibles, como en los filósofos griegos, en Dalton, los átomos de un elemento son idénticos entre sí. El último punto sigue siendo cierto en gran medida, con la excepción de los isótopos de varios elementos, que difieren en la cantidad de neutrones. Sin embargo, dado que el neutrón no se detectó hasta 1932, probablemente podamos perdonar a Dalton por este error. A Dalton también se le ocurrió la teoría de cómo los átomos se combinan para formar compuestos, y también introdujo el primer conjunto de símbolos químicos para elementos conocidos.
La presentación de la teoría atómica de Dalton fue el comienzo del desarrollo del modelo atómico moderno. Sin embargo, siguió otro período, donde nuestro conocimiento del átomo no progresó. Por supuesto, hubo intentos de comprender cómo pueden verse los átomos, por ejemplo, tales intentos fueron, por ejemplo, las suposiciones de Lord Kelvin de que los átomos son partículas de vórtice, cuya rotación explica sus propiedades básicas, por analogía con la teoría de los vórtices hidrodinámicos.
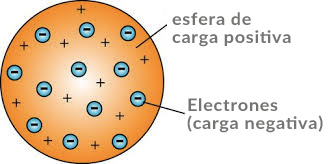
Modelo de pudín de ciruela – Joseph John Thomson
El primer avance se produjo a fines del siglo XIX, cuando el físico inglés Joseph John Thomson descubrió que el átomo no era tan indivisible como se dijo anteriormente. Realizó experimentos utilizando rayos catódicos (haces de electrones) producidos en un tubo de descarga, y descubrió que los rayos eran atraídos por placas de metal cargadas positivamente, pero repelidas por las de carga negativa. A partir de esto, concluyó que los rayos deberían estar cargados negativamente.
Al estudiar las partículas en los rayos, pudo concluir que eran dos mil veces más ligeras que el hidrógeno, y al cambiar el metal del cátodo, demostró que estas partículas estaban presentes en muchos tipos de átomos. Así descubrió el electrón (aunque lo llamó «corpúsculo») y demostró que los átomos no son indivisibles. Por este descubrimiento, recibió el Premio Nobel en 1906.
En 1904, presentó su modelo de átomo basado en sus hallazgos, llamado «modelo de pudín de átomo». Este modelo representaba el átomo como una esfera cargada positivamente, con electrones punteados en la esfera, como ciruelas en pudín. El modelo de Thomson pronto fue refutado por su alumno.
Modelo atómico – Ernest Rutherford
Ernest Rutherford era un físico de Nueva Zelanda, estudió en la Universidad de Cambridge con Thomson. Mientras trabajaba en la Universidad de Manchester, introdujo una nueva comprensión del modelo atómico. Su trabajo fue publicado después de recibir el Premio Nobel en 1908 por su investigación en la química de las sustancias radiactivas.
Rutherford desarrolló un experimento que ayudó a investigar la estructura atómica. Para hacer esto, disparó partículas alfa cargadas positivamente en una delgada lámina de lámina de oro. Las partículas alfa eran tan pequeñas que atravesaban una lámina de oro. Según el modelo de Thomson, en el que una carga positiva se difunde por todo el átomo, las partículas alfa tuvieron que pasar a través de la lámina prácticamente sin desviación. Al realizar este experimento, Rutherford esperaba confirmar el modelo de Thomson, su maestro, sin embargo, todo resultó ser exactamente lo contrario.
Durante el experimento, la mayoría de las partículas alfa pasaron a través de la lámina prácticamente sin deflexión. Sin embargo, un número muy pequeño de partículas se desvió del camino previsto, dirigiéndose al mismo tiempo en un ángulo muy grande. Fue completamente inesperado; Como el propio Rutherford comentó: «Fue casi tan increíble como si dispararas una concha de 15 pulgadas en papel de seda y él volviera y te golpeara». La única explicación posible fue que la carga positiva no se extendió por todo el átomo, sino que se localizó en un centro pequeño y denso: el núcleo. Según esto, la mayoría del resto del átomo era simplemente un espacio vacío.
El descubrimiento de Rutherford del núcleo significó la necesidad de repensar el modelo atómico. Propuso un modelo en el que los electrones giran alrededor de un núcleo cargado positivamente. Sin embargo, no explicó que mantiene los electrones girando alrededor del núcleo en lugar de simplemente caer sobre el núcleo.
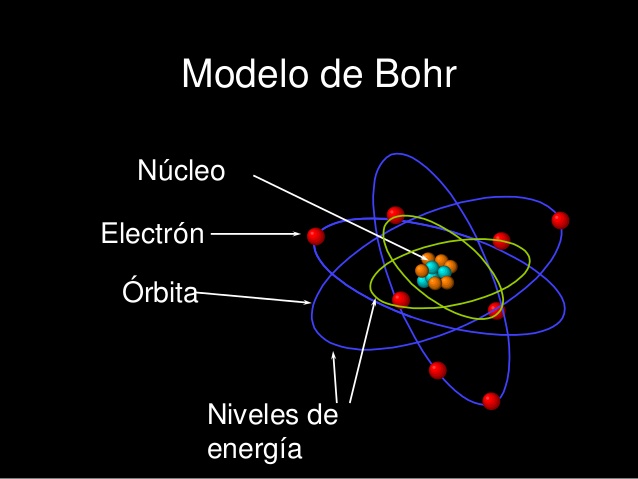
Modelo planetario – Niels bohr
Un nuevo modelo fue presentado por Niels Bohr. Bohr era un físico danés que se dedicó a resolver problemas relacionados con el modelo de Rutherford. Como la física clásica no podía explicar correctamente lo que está sucediendo a nivel atómico, recurrió a la teoría cuántica para explicar la disposición de los electrones. Su modelo postulaba la existencia de niveles de energía o capas de electrones. Los electrones solo pueden estar en estos niveles de energía; En otras palabras, su energía se cuantifica y no puede tomar ningún valor entre los niveles cuantificados. Los electrones pueden moverse entre estos niveles de energía (llamados Bohr como «estados estacionarios»), pero bajo la condición de absorción o emisión de energía.

La propuesta de Bohr de niveles de energía estables resolvió en cierta medida el problema de la caída de electrones en espiral hacia el núcleo. Las verdaderas causas son más complejas y ocultas en el complejo mundo de la mecánica cuántica; y, como dijo el propio Bohr: «Si la mecánica cuántica no lo conmocionó hasta el núcleo, simplemente lo entendió (o aún no entiende la mecánica cuántica lo suficientemente bien)».
El modelo de Bohr no resuelve todos los problemas del modelo atómico. Es adecuado para átomos de hidrógeno, pero no puede explicar observaciones de elementos más pesados. También viola el principio de incertidumbre de Heisenberg, una de las piedras angulares de la mecánica cuántica, que establece que no podemos conocer la ubicación exacta y el momento de un electrón al mismo tiempo. Sin embargo, el modelo del átomo de Bohr es el más extendido y conocido, lo que se asocia con la conveniencia de explicar los enlaces químicos y la reactividad de algunos grupos de elementos en la etapa inicial del entrenamiento.
En cualquier caso, el modelo aún requiere procesamiento. Por el momento, muchos científicos han estado investigando e intentando desarrollar un modelo cuántico del átomo. El principal de ellos fue el físico austriaco Erwin Schrödinger, a quien probablemente conoces gracias al gato Schrödinger. En 1926, Schrödinger sugirió que los electrones y otras partículas elementales se comportan como ondas en la superficie del océano. Con el tiempo, el pico de la onda (correspondiente al lugar donde probablemente se ubicará el electrón) se desplaza en el espacio de acuerdo con la ecuación que describe esta onda. Es decir, lo que tradicionalmente consideramos una partícula, en el mundo cuántico se comporta como una onda.
Modelo cuántico de Erwin Schrödinger
Schrödinger resolvió una serie de ecuaciones matemáticas para describir el modelo de distribución de electrones en un átomo. Su modelo muestra un núcleo rodeado de nubes de densidad electrónica. Estas nubes son nubes de probabilidad; aunque no sabemos exactamente dónde están los electrones en un momento dado, pero sí sabemos en qué áreas del espacio se pueden ubicar. Estas secciones del espacio se llaman órbitas electrónicas. Queda claro por qué en la escuela secundaria las clases de química a menudo no proporcionan este modelo, ¡aunque este modelo se considera el más preciso!
Ya después de Schrödinger, en 1932, el físico inglés James Chadwick (estudiante de Ernest Rutherford) descubrió la existencia de un neutrón, completando nuestra imagen de las partículas subatómicas que forman un átomo. Sin embargo, la historia no termina ahí; Los físicos han descubierto que los protones y los neutrones que forman el núcleo están divididos en partículas llamadas quarks, ¡pero esa es otra historia completamente diferente! En cualquier caso, el modelo atómico nos da un gran ejemplo de cómo los modelos científicos pueden cambiar con el tiempo, y muestra cómo los nuevos datos pueden conducir a nuevos modelos.